Akku – Wir erklären wie er funktioniert

Ein Akkumulator (kurz Akku; auch Sekundärbatterie genannt) ist ein wiederaufladbares galvanisches Element, bestehend aus zwei Elektroden und einem Elektrolyten, das elektrische Energie auf elektrochemischer Basis speichert. Akkus und Batterien sind aus unserem Alltag heute nicht mehr weg zu denken. In neuerer Zeit fahren selbst unsere Autos mit einem Akku. Es ist an der Zeit einmal genauer hinzusehen, was ein Akku ist und wir er funktioniert. Was könnte gegen einen Akku sprechen? Wir erklären ganz einfach, wie ein Akku funktioniert, was der Unterschied zu einer Batterie ist und ob es Alternativen gibt.
Definition Akkumulator – Akku genannt
Ein Akkumulator (kurz Akku) ist ein wiederaufladbares galvanisches Element, bestehend aus zwei Elektroden und einem Elektrolyten, das elektrische Energie auf elektrochemischer Basis speichert. Der Begriff Akku lässt sich auf das lateinische Wort „accumulator“ zurückführen und bedeutet „Sammler“. Mit dem Akkumulator ist ein einzelnes wiederaufladbares Speicherelement gemeint (Sekundärzelle). Im allgemeinen Sprachgebrauch benutzen wir das Wort Akku oft für zusammengeschaltete Sekundärzellen. Wenn man es genau nimmt, unterscheiden wir jedoch, ob es um eine einzelne Zelle geht (Akkumulator; Akkuzelle) oder um ein zusammengeschaltetes Speicherelement (Akkupack, Batterie aus Sekundärzellen).
Demnach gibt es Batterien aus Primärzellen (nicht wiederaufladbar) und welche aus Sekundärzellen (wiederaufladbar). Die Batterie ist im technischen Sinne ein Zusammenschluss aus mehreren gleichartigen galvanischen Zellen. Im englischen wird übrigens für beide Varianten das Wort „battery“ genutzt, daher wird im wissenschaftlichen Bereich von einem Akku, auch von einer aufladbaren Batterien gesprochen.
Ein Kondensator ist auch ein Speicher für elektrische Energie, aber dieser speichert die Energie nicht in chemischer Form, wie in der Batterie, sondern als elektrisches Feld zwischen ihren Platten. Daher ist der Kondensator kein Akku im herkömmlichen Sinne.
Prinzipielle Funktionsweise eines Akkumulators
Ein Akku funktioniert wie folgt: In einem Behälter befindet sich eine elektrisch leitende Flüssigkeit (Elektrolyt). Darin sind zwei unterschiedliche leitfähige Metalle (Elektroden) eingetaucht. Sie erzeugen durch die verschiedenen chemischen Zusammensetzungen untereinander eine Spannung. Diese Eigenschaft von Metallen entdeckte Alessandro Volta 1793 und definierte sie in der „Voltaschen Spannungsreihe“. Sie besagt: Je weiter zwei bestimmte Metalle in der Spannungsreihe auseinander liegen, desto höher ist die elektrische Spannung zwischen diesen Elementen.
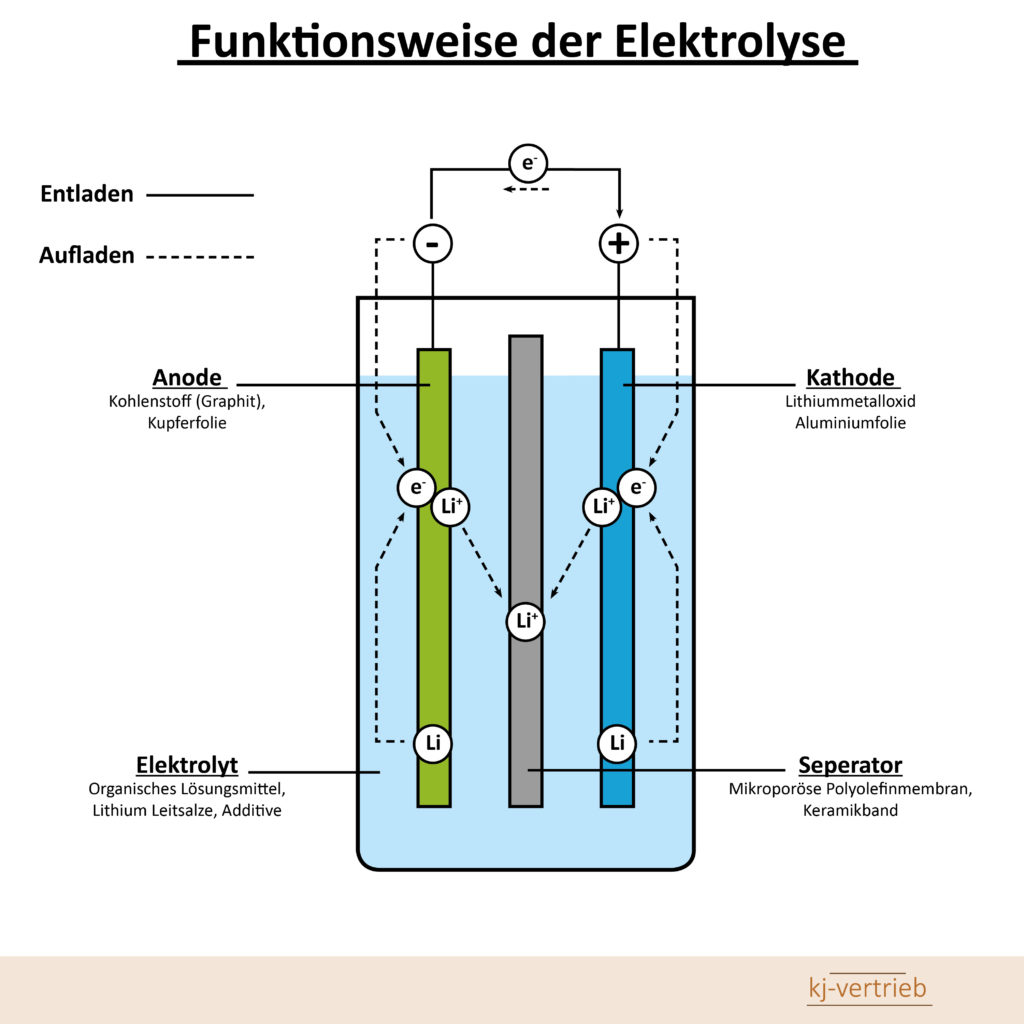
Funktionsprinzip einer Akkuzelle:
Durch einen elektrochemischen Prozess entsteht ein Spannungspotenzial zwischen der sogenannten Anode und Kathode. Im Elektrolyt trennt eine poröse Wand (Separator) die beiden Metallelektroden (Anode und Kathode), um einen Kurzschluss durch Berührung zu vermeiden. An der Anode herrscht Elektronenüberfluss und an der Kathode Elektronenmangel. Diese Elektronendifferenz definiert die elektrische Spannung. Ein Verbraucher zwischen den Elektroden ermöglicht den Elektronen, die Spannung abzubauen.
Den Elektronenfluss von der Anode zur Kathode bezeichnet man als elektrischen Strom. Die Strommenge, die ein Akku über einen Zeitintervall abgeben kann, heißt Kapazität. Für einen ständigen Elektronenfluss muss der Stromkreislauf im Elektrolyt geschlossen sein. Das übernimmt der elektrochemische Prozess im Elektrolyt durch Oxidation und Reduktion der entsprechend verwendeten Metalle. Wird der Stromkreislauf unterbrochen, stoppt der Prozess der „Entladung“ – allerdings nicht vollständig. Daher kann es passieren, wenn man einen Akku länger nicht benutzt, das dieser tiefenentlädt.
Bedingt durch einen temperaturabhängigen Reaktionsprozess im Akku wandern Ladungen zwischen den Elektroden und entladen das chemische System. Man spricht dabei von Selbstentladung. Je nach Akkutyp beträgt sie bis zu 30 Prozent der gespeicherten Kapazität pro Monat. Um einen Akku aufzuladen, pumpt ein Ladegerät Elektronen von der Kathode zur Anode und reaktiviert so die entladenen Elektroden. Der Lade- und Entladevorgang lässt sich je nach Akkutyp bis zu etwa 1000 Mal wiederholen.
Die Akku-Typen
Lithium-Ion-Akku
Ein Lithium-Ionen Akku besitzt die höchste spezifische Energie unter den wiederaufladbaren Systemen. Des weiteren weist dieser Akku eine geringe Selbstentladung auf und ist somit über lange Zeit lagerfähig ohne das ein erneutes Aufladen der Zellen nötig ist. Auch liefert die Lithium-Ionen-Zelle über den gesamten Entladezeitraum eine nahezu konstante Ausgangsspannung, die deutlich über der Nennspannung von zirka 3,6 V liegt.
Als Material im Akku für die Kathodenelektrode wird eine Lithiumverbindung verwendet, die aus Cobalt-, Mangan- oder Nickel-Oxid bestehen kann. Die Anode setzt sich aus einer Graphitverbindung zusammen. Die Isolierung zwischen den beiden Elektroden besteht aus einer mikrodurchlässigen Kunststoffmembran. Als Elektrolyt dient ein gelöstes Lithium-Salz in einem organischen Lösungsmittel.
Lithium-Polymer-Akku
Die Lithium-Polymer-Akkus besitzen prinzipiell den gleichen Aufbau wie die Lithium-Ionen Zelle, mit dem Unterschied: dass sie keine wässrigen Elektrolyte enthalten und daher auslaufsicher sind. Den flüssigen Reaktionsstoff ersetzten die Entwickler durch ein festes beziehungsweise gelartiges Polymerelektrolyt. Der Lithium-Polymer-Akku verfügt über die gleiche hohe spezifische Energie, wie das Lithium-Ionen-Pendant. Durch das feste Polymer-Elektrolyt lassen sich die Abmessungen des Akkus (Gehäuseformen) frei variieren. Mehr zum Thema Lithium-Polymer Akkus findet man unter unserem Blog Artikel „Kleiner Leitfaden – LiPo Akkus für RC Anwendungen“.
Blei-Säure-Akku
Die positive Elektrode eines herkömmlichen offenen Blei-Säure-Akkus besteht aus Bleidioxid (PbO2), als negatives Elektrodenmaterial kommen Bleiplatten zum Einsatz. Zwischen den Elektrodenplatten befindet sich ein Separator, der aus Glasfaser, Mikroglas oder PVC bestehen kann. Als Elektrolyt dient in einer Flüssigkeit gelöste Schwefelsäure. Mittlerweile ersetzen die Entwickler aus Effizienzgründen die Flüssigkeit durch eine gelartige Masse, die eine rasche Ausgasung des gebundenen Elektrolyts verhindert. Als Bauform kommt ein geschlossenes gasdichtes System zum Einsatz. Dies schützt den Akku vor rascher „Austrocknung“ und verlängert die Lebensdauer
Nickel-Metallhydrid-Akku
Der Pluspol der Energiezelle enthält Nickel-Hydroxid, und der Minuspol besteht aus einer Metalllegierung, die Wasserstoff binden kann. Der Aufbau gasdichter NiMH-Akkus entspricht prinzipiell denen von NiCd-Zellen. Aufbau einer NiMH-Akkurundzelle: Anders als die NiCd-Zelle enthält der NiMH-Akku kein hochgiftiges Schwermetall. Im mechanischen Aufbau unterscheiden sich die beiden Technologien kaum. Auf Grund der guten Umweltverträglichkeit und einer sehr hohen Kapazität umfasst das Einsatzgebiet des NiMH-Akkus vorwiegend Handys, Camcorder, Notebooks und Audio Geräte.
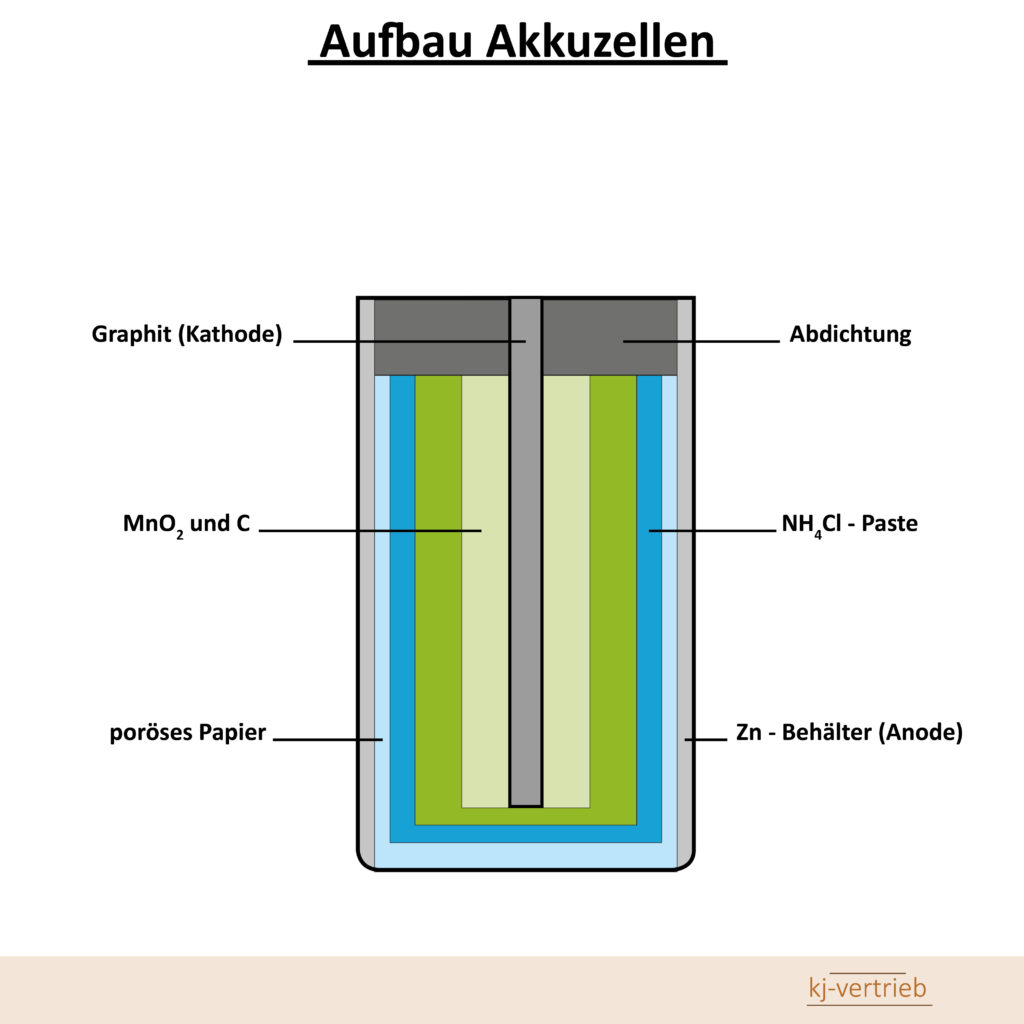
Nickel-Cadmium-Akku
Wie der Name suggeriert, besteht ein Nickel-Cadmium-Akkumulator aus der negativen Cadmium- und der positiven Nickel-Hydroxid-Elektrode. Als Elektrolyt kommt KaliumHydroxid zum Einsatz. Aufbau einer NiCd-Akkurundzelle: Bedingt durch das hochgiftige Cadmium müssen die Akkus absolut gasdicht aufgebaut sein. Durch die sehr hohe Belastbarkeit der NiCd-Akkus kommen sie heute vorwiegend in Geräten mit hohem Strombedarf zum Einsatz. Dazu zählen in erster Linie Akkuwerkzeuge. Aber auch in schnurlosen Telefonen und Camcordern werden sie auf Grund der geringen Herstellungskosten gerne eingesetzt.
Vielversprechende Alternative
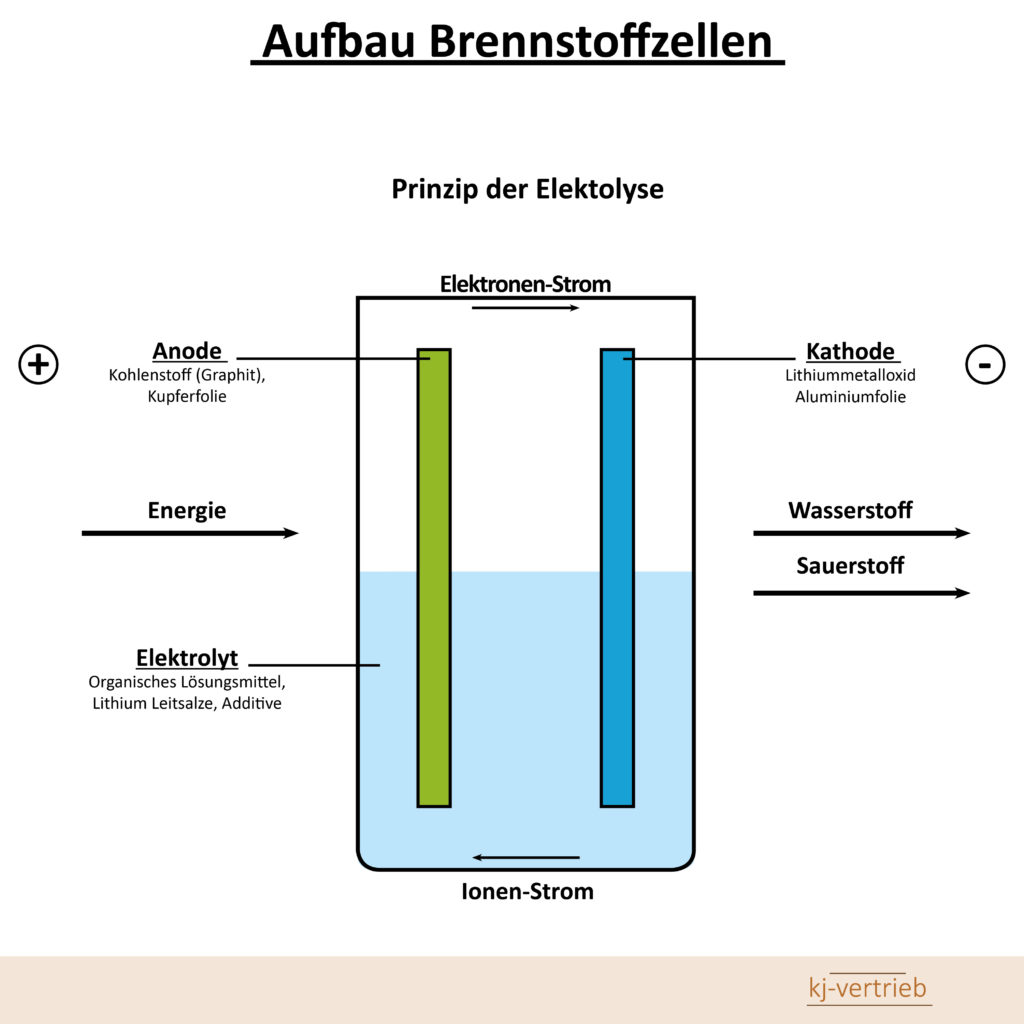
Im Bereich mobiler Energieversorgung besitzt die Brennstoffzellen-Technologie gegenüber den klassischen Verfahren wie NiCd, NiMH und Lithium-Ion das größte Zukunftspotenzial. Die Brennstoffzelle kehrt das herkömmliche Verfahren der Elektrolyse, das unter Zuführung von elektrischer Energie Wasser in die Gase Sauerstoff und Wasserstoff aufspaltet, um. Der so gewonnene Wasserstoff dient als Energieträger bei Verbrennungsprozessen (Knallgaseffekt). Die Elektrolyse: Unter Zuführung von Energie wird das Elektrolyt (wässrige Salzlösung) in Wasserstoff und Sauerstoff aufgespalten. Der prinzipielle Funktionsprozess der Brennstoffzelle verwendet Luftsauerstoff und Wasserstoff als Energielieferant. In einem chemischen Verfahren – der so genannten „kalten Verbrennung“ – wandelt sie die beiden Elemente in elektrische Energie um. Als Abfallprodukt entstehen Wärme und Wasser. Diese Methode erzeugt doppelt so viel Energie
wie das klassische Verbrennungsverfahren.
Die Brennstoffzelle erzeugt in einer „kalten Verbrennung“ von Luft und Wasserstoff elektrische Energie und Wärme.
Die Brennstoffzelle ist in ihrer Struktur sehr einfach aufgebaut. Die wichtigste Komponente einer Brennstoffzelle ist eine leicht durchlässige elektrolytische Membran auf Polymerbasis. Sie verhindert, dass die beiden Reaktionsstoffe Wasserstoff und Luftsauerstoff sich zu Wasser verbinden, da sie nur Kerne der Wasserstoffatome (Protonen) passieren lässt. Die Elektroden der Anode und Kathode dienen als Katalysator für den Wasserstoff beziehungsweise Luftsauerstoff.
Vorteile der Brennstoffzellen-Technologie sind ein hoher Wirkungsgrad und eine hohe Energiedichte gegenüber den aktuellen Akkusystemen. Ein Nachteil ist der geringe Strom, den die Brennstoffzelle liefert. So benötigen derzeitige Prototypen von Brennstoffzellen in mobilen Geräten immer noch Energiepuffer in Form von Akkus, um kurzzeitig hohe Ströme an das elektrische System zu liefern. In diesem Aufbau besteht die Aufgabe der Brennstoffzelle lediglich im stetigen Nachladen der Akkuzellen
Zusammenfassung
Die herkömmlichen Akkutechnologien wie NiCd und NiMH sind technologisch nahezu ausgereizt. Die NiMH-Akkus gehören heute zu den gängigsten wiederaufladbaren Energielieferanten. Ein hohes Entwicklungspotenzial für den mobilen Einsatz besitzt zurzeit die Lithium-Ionenbeziehungsweise Lithium-Polymer-Technologie. Sie bietet eine hohe spezifische Energie, geringe Selbstentladung. Der Blei-Säure-Akku zählt zu den ältesten und immer noch weltweit meistgenutzten Energielieferanten. Als Notstromreserve in USVs oder Starterbatterien bietet diese Akkutechnologie ein konkurrenzloses Preis-Leistungs-Verhältnis, da als Grundstoff das preiswerte und in großen Mengen verfügbare Schwermetall Blei eingesetzt wird.
Als zukünftige Energieversorger für mobile Geräte und Fahrzeuge kommen die Brennstoffzelle und die Zink-Luft-Akkutechnologie in Frage. Die ersten Prototypen und Kleinserien sind sehr vielversprechend. Auf jeden fall eine zukunftweisende Technologie.
Mehr spannende und interessante Artikel findet man bei uns im Blog!